SA. Газовые законы. Основные термодинамические процессы Изопроцессы идеального газа и их графики
, термодинамическим процессом называют изменение состояния системы , в результате которого хотя бы один из ее параметров (температура, объем или давление) изменяет свое значение. Впрочем, если учесть, что все параметры термодинамической системы неразрывно взаимосвязаны, то изменение любого из них неизбежно влечет изменение хотя бы одного (в идеале) или нескольких (в реальности) параметров. В общем случае можно сказать, что термодинамический процесс связан с нарушением равновесия системы, и если система находится в равновесном состоянии, то никаких термодинамических процессов в ней протекать не может.
Равновесное состояние системы - понятие абстрактное, поскольку невозможно изолировать что-либо материальное от окружающего мира, поэтому в любой реальной системе неизбежно протекают разнообразные термодинамические процессы. При этом в некоторых системах могут иметь место настолько медленные, почти незаметные изменения, что связанные с ними процессы можно условно считать состоящими из последовательности равновесных состояний системы. Такие процессы называют равновесными
или квазистатическими
.
Еще один возможный сценарий последовательных изменений в системе, после которых она возвращается к исходному состоянию, называют круговым процессом
или циклом
. Понятия равновесного и кругового процесса лежат в основе многих теоретических выводов и прикладных приемов термодинамики.
Изучение термодинамического процесса заключается в определении работы, совершенной в данном процессе, изменения внутренней энергии, количества теплоты, а также в установлении связи между отдельными величинами, характеризующими состояние газа.
Из всех возможных термодинамических процессов наибольший интерес представляют изохорный , изобарный , изотермический , адиабатный и политропный процессы.
Изохорный процесс
Изохорным называют термодинамический процесс, протекающий при постоянном объеме. Такой процесс может совершаться при нагревании газа, помещенного в закрытый сосуд. Газ в результате подвода теплоты нагревается, и его давление возрастает.
Изменение параметров газа в изохорном процессе описывает закон Шарля : p 1 /T 1 = p 2 /T 2
, или в общем случае:
p/T = const .
Давление газа на стенки сосуда прямо пропорционально абсолютной температуре газа.
Так как в изохорном процессе изменение объема dV равно нулю, то можно сделать вывод, что вся подведенная к газу теплота расходуется на изменение внутренней энергии газа (никакая работа не совершается) .
Изобарный процесс
Изобарным называют термодинамический процесс, протекающий при постоянном давлении. Такой процесс можно осуществить, поместив газ в плотный цилиндр с подвижным поршнем, на который действует постоянная внешняя сила при отводе и подводе теплоты.
При изменении температуры газа поршень перемещается в ту или иную сторону; при этом объем газа изменяется в соответствии с законом Гей-Люссака :
V/T = const .
Это означает, что в изобарном процессе объем занимаемый газом, прямо пропорционален температуре.
Можно сделать вывод, что изменение температуры в этом процессе неизбежно приведет к изменению внутренней энергии газа, а изменение объема связано с выполнением работы, т. е. при изобарном процессе часть тепловой энергии тратится на изменение внутренней энергии газа, а другая часть – на выполнение газом работы по преодолению действия внешних сил. При этом соотношение между затратами теплоты на увеличение внутренней энергии и на выполнение работы зависит от теплоемкости газа.
Изотермический процесс
Изотермическим называют термодинамический процесс, протекающий при неизменной температуре.
Практически осуществить изотермический процесс с газом очень трудно. Ведь необходимо соблюсти условие, чтобы в процессе сжатия или расширения газ успевал обмениваться температурой с окружающей средой, поддерживая собственную температуру постоянной.
Изотермический процесс описывается законом Бойля-Мариотта : pV = const
, т. е. при постоянной температуре величина давления газа обратно пропорциональна его объему.
Очевидно, что при изотермическом процессе внутренняя энергия газа не изменяется, поскольку его температура постоянна.
Чтобы выполнялось условие постоянства температуры газа, от него необходимо отводить теплоту, эквивалентную работе, затраченной на сжатие:
dq = dA = pdv .
Используя уравнение состояния газа, проделав ряд преобразований и подстановок, можно сделать вывод, что работа газа при изотермическом процессе определяется выражением:
A = RT ln(p 1 /p 2).
Адиабатный процесс
Адиабатным называют термодинамический процесс, протекающий без теплообмена рабочего тела с окружающей средой. Подобно изотермическому, осуществить на практике адиабатный процесс очень сложно. Такой процесс может протекать с рабочим телом, помещенным в сосуд, например, цилиндр с поршнем, окруженный высококачественным теплоизолирующим материалом.
Но какой бы качественный теплоизолятор мы не применяли в данном случае, некоторым, пусть даже ничтожно малым, количеством теплоты рабочее тело и окружающая среда неизбежно будут обмениваться.
Поэтому на практике можно создать лишь приближенную модель адиабатного процесса. Тем не менее, многие термодинамические процессы, осуществляемые в теплотехнике, протекают настолько быстро, что рабочее тело и среда не успевают обмениваться теплотой, поэтому с некоторой степенью погрешности такие процессы можно рассматривать как адиабатные.
Для вывода уравнения, связывающего давление и объем 1 кг газа в адиабатном процессе, запишем уравнение первого закона термодинамики:
dq = du + pdv .
Поскольку для адиабатного процесса теплопередача dq равна нулю, а изменение внутренней энергии есть функция теплопроводности от температуры: du = c v dT , то можно записать:
c v dT + pdv = 0 (3) .
Продифференцировав уравнение Клапейрона pv = RT , получим:
pdv + vdp = RdT .
Выразим отсюда dT и подставим в уравнение (3) . После перегруппировки и преобразований получим:
pdvc v /(R + 1) + c v vdp/R = 0 .
С учетом уравнения Майера R = c p – c v последнее выражение можно переписать в виде:
pdv(c v + c p - c v)/(c p – c v) + c v vdp/(c p – c v) = 0 ,
c p pdv + c v vdp = 0 (4) .
Разделив полученное выражение на c v и обозначив отношение c p /c v буквой k , после интегрирования уравнения (4) получим (при k = const) :
ln vk + ln p = const или ln pvk = const или pvk = const .
Полученное уравнение является уравнением адиабатного процесса, в котором k
– показатель адиабаты.
Если предположить, что объемная теплоемкость c v
является величиной постоянной, т. е. c v = const
, то работу адиабатного процесса можно представить в виде формулы (приводится без вывода)
:
l = c v (T 1 – T 2) или l = (p 1 v 1 – p 2 v 2)/(k-1) .
Политропный процесс
В отличие от рассмотренных выше термодинамических процессов, когда какой-либо из параметров газа оставался неизменным, политропный процесс характеризуется возможностью изменения любого из основных параметров газа. Все рассмотренные выше термодинамические процессы являются частными случаями политропных процессов.
Общее уравнение политропного процесса имеет вид pv n = const
, где n
– показатель политропы - постоянная для данного процесса величина, которая может принимать значения от - ∞
до + ∞
.
Очевидно, что придавая показателю политропы определенные значения, можно получить тот или иной термодинамический процесс – изохорный, изобарный, изотермический или адиабатный.
Так, если принять n = 0
, получим p = const
– изобарный процесс, если принять n = 1
, получим изотермический процесс, описываемый зависимостью pv = const
; при n = k
процесс является адиабатным, а при n равном - ∞
или + ∞
. мы получим изохорный процесс.
Основными процессами в термодинамике являются:
- изохорный , протекающий при постоянном объеме;
- изобарный , протекающий при постоянном давлении;
- изотермический , происходящий при постоянной температуре;
- адиабатный , при котором теплообмен с окружающей средой отсутствует;
- политропный , удовлетворяющий уравнению pv n = const.
Изохорный, изобарный, изотермический и адиабатный процессы являются частными случаями политропного процесса.
При исследовании термодинамических процессов определяют:
- уравнение процесса в p — v иT — s координатах;
- связь между параметрами состояния газа;
- изменение внутренней энергии;
- величину внешней работы;
- количество подведенной теплоты на осуществление процесса или количество отведенной теплоты.
Изохорный процесс


Изохорный процесс в p , v — , T , s — и i , s -координатах (диаграммах)
При изохорном процессе выполняется условие v = const.
Из уравнения состояния идеального газа (pv = RT ) следует:
p/T = R/v = const,
т. е. давление газа прямо пропорционально его абсолютной температуре:
p 2 /p 1 = T 2 /T 1 .
Работа расширения в изохорном процессе равна нулю (l = 0), так как объем рабочего тела не меняется (Δv = const).
Количество теплоты, подведенной к рабочему телу в процессе 1-2 при c v
q = c v (T 2 — T 1 ).
Т. к.l = 0, то на основании первого закона термодинамики Δu = q , а значит изменение внутренней энергии можно определить по формуле:
Δu = c v (T 2 — T 1) .
Изменение энтропии в изохорном процессе определяется по формуле:
s 2 – s 1 = Δs = c v ln(p 2 /p 1 ) = c v ln(T 2 /T 1 ).
Изобарный процесс



Изобарный процесс в p , v — , T , s — и i , s -координатах (диаграммах)
Изобарным называется процесс, протекающий при постоянном давлении p = const. Из уравнения состояния идеального газа слуедует:
v/T = R/p = const
v 2 /v 1 = T 2 /T 1 ,
т. е. в изобарном процессе объем газа пропорционален его абсолютной температуре.
Работа будет равна:
l = p (v 2 – v 1 ).
Т. к. pv 1 = RT 1 и pv 2 = RT 2 , то
l = R (T 2 – T 1 ).
Количество теплоты при c p = const определяется по формуле:
q = c p (T 2 – T 1 ).
Изменение энтропии будет равно:
s 2 – s 1 = Δs = c p ln(T 2 /T 1 ).
Изотермический процесс



Изотермический процесс в p , v — , T , s — и i , s -координатах (диаграммах)
При изотермическом процессе температура рабочего тела остается постоянной T = const, следовательно:
pv = RT = const
p 2 /p 1 = v 1 /v 2 ,
т. е. давление и объем обратно пропорциональны друг другу, так что при изотермическом сжатии давление газа возрастает, а при расширении – снижается.
Работа процесса будет равна:
l = RT ln (v 2 – v 1 ) = RT ln (p 1 – p 2 ).
Так как температура остается неизменной, то и внутренняя энергия идеального газа в изотермическом процессе остается постоянной (Δu = 0) и вся подводимая к рабочему телу теплота полностью превращается в работу расширения:
q = l .
При изотермическом сжатии от рабочего тела отводится теплота в количестве, равном затраченной на сжатие работе.
Изменение энтропии равно:
s 2 – s 1 = Δs = R ln(p 1 /p 2 ) = R ln(v 2 /v 1 ).
Адиабатный процесс



Адиабатный процесс в p , v — , T , s — и i , s -координатах (диаграммах)
Адиабатным называется процесс изменения состояния газа, который происзодит без теплообмена с окружающей средой. Так как dq = 0, то уравнение первого закона термодинамики для адиабатного процесса будет иметь вид:
du + p dv = 0
Δu + l = 0,
следовательно
Δu = —l .
В адиабатном процессе работа расширения совершается только за счет расходования внутренней энергии газа, а при сжатии, происходящем за счет действия внешних сил, вся совершаемая ими работа идет на увеличение внутренней энергии газа.
Обозначим теплоемкость в адиабатном процессе через c ад, и условие dq = 0 выразим следующим образом:
dq = c ад dT = 0.
Это условие говорит о том, что теплоемкость в адиабатном процессе равна нулю (c ад = 0).
Известно, что
с p /c v = k
и уравнение кривой адиабатного процесса (адиабаты) в p , v -диаграмме имеет вид:
pv k = const.
В этом выражении k носит название показателя адиабаты (так же ее называют коэффициентом Пуассона).
Значения показателя адиабаты k для некоторых газов:
k воздуха = 1,4
k перегретого пара = 1,3
k выхлопных газов ДВС = 1,33
k насыщенного влажного пара = 1,135
Из предыдущих формул следует:
l = — Δu = c v (T 1 – T 2 );
i 1 – i 2 = c p (T 1 – T 2 ).
Техническая работа адиабатного процесса (l техн) равна разности энтальпий начала и конца процесса (i 1 – i 2 ).
Адиабатный процесс, происходящий без внутреннего трения в рабочем теле, называется изоэнтропийным . В T , s -диаграмме он изображается вертикальной линией.
Обычно реальные адиабатные процессы протекают при наличии внутреннего трения в рабочем теле, в результате чего всегда выделяется теплота, которая сообщается самому рабочему телу. В таком случае ds > 0, и процесс называется реальным адиабатным процессом .
Политропный процесс
Политропным называется процесс, который описывается уравнением:
pv n = const.
Показатель политропы n может принимать любые значения в пределах от -∞ до +∞, но для данного процесса он является постоянной величиной.
Из уравнения политропного процесса и уравнения Клайперона можно получить выражение, устанавливающее связь между p , v и T в любых двух точках на политропе:
p 2 /p 1 = (v 1 /v 2 ) n ; T 2 /T 1 = (v 1 /v 2 ) n-1 ; T 2 /T 1 = (p 2 /p 1 ) (n-1)/n .
Работа расширения газа в политропном процессе равна:

В случае идеального газа эту формулу можно преобразовать:

Количество подведенной или отведенной в процессе теплоты определяется с помощью первого закона термодинамики:
q = (u 2 – u 1 ) + l .
Поскольку

представляет собой теплоемкость идеального газа в политропном процессе.
При c v , k и n = const c n = const, поэтому политропный процесс иногда определят как процесс с постоянной теплоемкостью.
Политропный процесс имеет обобщающее значение, ибо охватывает всю совокупность основных термодинамических процессов.
Графическое представление политропа в p , v координатах в зависимости от показателя политропа n .

pv 0 = const (n = 0) – изобара;
pv = const (n = 1) – изотерма;
p 0 v = const, p 1/∞ v = const, pv ∞ = const – изохора;
pv k = const (n = k ) – адиабата.
n > 0 – гиперболические кривые,
n < 0 – параболы.
По материалам моего конспекта лекций по термодинамике и учебника «Основы энергетики». Автор Г. Ф. Быстрицкий. 2-е изд., испр. и доп. - М. :КНОРУС, 2011. - 352 с.
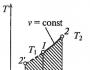
На этом уроке мы продолжим изучать связь между тремя макроскопическими параметрами газа, а конкретнее - их взаимосвязь в газовых процессах, протекающих при постоянном значении одного из этих трёх параметров, или изопроцессах: изотермических, изохорных и изобарных.
Рассмотрим следующий изопроцесс - изобарный процесс.
Определение. Изобарный (или изобарический ) процесс - процесс перехода идеального газа из одного состояния в другое при постоянном значении давления. Впервые такой процесс рассмотрел французский учённый Жозеф-Луи Гей-Люссак (рис. 4), поэтому закон носит его имя. Запишем этот закон
![]()
А теперь учитывая: и
Закон Гей-Люссака
Из этого закона очевидно следует прямо пропорциональная связь между температурой и объёмом: при увеличении температуры наблюдается увеличение объёма, и наоборот. График зависимости меняющихся величин в уравнении, то есть T и V, имеет следующий вид и называется изобарой (рис. 3):

Рис. 3. Графики изобарных процессов в координатах V-T ()
Следует обратить внимание на то, что, поскольку мы работаем в системе СИ, то есть с абсолютной шкалой температур, на графике присутствует область, близкая к абсолютному нулю температур, в которой данный закон не выполняется. Поэтому прямую в области, близкой к нулю, следует изображать пунктирной линией.

Рис. 4. Жозеф Луи Гей-Люссак ()
Рассмотрим, наконец, третий изопроцесс.
Определение. Изохорный (или изохорический ) процесс - процесс перехода идеального газа из одного состояния в другое при постоянном значении объёма. Процесс рассмотрен впервые французом Жаком Шарлем (рис. 6), поэтому закон носит его имя. Запишем закон Шарля:
Снова запишем обычное уравнение состояния: ![]()
А теперь учитывая: и
Получаем: для любых различных состояний газа, или же просто:
Закон Шарля
Из этого закона очевидно следует прямо пропорциональная связь между температурой и давлением: при увеличении температуры наблюдается увеличение давления, и наоборот. График зависимости меняющихся величин в уравнении, то есть T и P, имеет следующий вид и называется изохорой (рис. 5):

Рис. 5. Графики изохорных процессов в координатах V-T
В районе абсолютного нуля для графиков изохорного процесса также существует лишь условная зависимость, поэтому прямую также следует доводить до начала координат пунктиром.

Рис. 6. Жак Шарль ()
Стоит обратить внимание, что именно такая зависимость температуры от давления и объёма при изохорных и изобарных процессах соответственно определяет эффективность и точность измерения температуры с помощью газовых термометров.
Интересен также тот факт, что исторически первыми были открыты именно рассматриваемые нами изопроцессы, которые, как мы показали, являются частными случаями уравнения состояния, а уже потом уравнения Клапейрона и Менделеева-Клапейрона. Хронологически сначала были исследованы процессы, протекающие при постоянной температуре, затем при постоянном объёме а последними - изобарические процессы.
Теперь для сравнения всех изопроцессов мы собрали их в одну таблицу (см рис. 7). Обратите внимание, что графики изопроцессов в координатах, содержащих неизменяющийся параметр, собственно говоря, и выглядят как зависимость константы от какой-либо переменной.
Рис. 7.
На следующем уроке мы рассмотрим свойства такого специфического газа, как насыщенный пар, подробно рассмотрим процесс кипения.
Список литературы
- Мякишев Г.Я., Синяков А.З. Молекулярная физика. Термодинамика. - М.: Дрофа, 2010.
- Генденштейн Л.Э., Дик Ю.И. Физика 10 класс. - М.: Илекса, 2005.
- Касьянов В.А. Физика 10 класс. - М.: Дрофа, 2010.
- Slideshare.net ().
- E-science.ru ().
- Mathus.ru ().
Домашнее задание
- Стр. 70: № 514-518. Физика. Задачник. 10-11 классы. Рымкевич А.П. - М.: Дрофа, 2013. ()
- Какова зависимость между температурой и плотностью идеального газа при изобарном процессе?
- При надувании щёк и объём, и давление во рту возростают пр неизменной температуре. Противоречит ли это закону Бойля-Мариотта? Почему?
- *Как будет выглядеть график данного процесса в координатах P-V?

ОПРЕДЕЛЕНИЕ
Процессы, при которых один из параметров состояния газа остается постоянным называют изопроцессами .
ОПРЕДЕЛЕНИЕ
Газовые законы - это законы, описывающие изопроцессы в идеальном газе.
Газовые законы были открыты экспериментально, но все они могут быть получены из уравнения Менделеева-Клапейрона.
Рассмотрим каждый из них.
Закон Бойля-Мариотта (изотермический процесс)
Изотермическим процессом называют изменение состояния газа, при котором его температура остаётся постоянной.
Для неизменной массы газа при постоянной температуре произведение давления газа на объем есть величина постоянная:
Этот же закон можно переписать в другом виде (для двух состояний идеального газа):
Этот закон следует из уравнения Менделеева - Клапейрона:
![]()
Очевидно, что при неизменной массе газа и при постоянной температуре правая часть уравнения остается постоянной величиной.
Графики зависимости параметров газа при постоянной температуре называются изотермами .
Обозначив константу буквой , запишем функциональную зависимость давления от объема при изотермическом процессе:
Видно, что давление газа обратно пропорционально его объему. Графиком обратной пропорциональности, а, следовательно, и графиком изотермы в координатах является гипербола (рис.1, а). На рис.1 б) и в) представлены изотермы в координатах и соответственно.

Рис.1. Графики изотермических процессов в различных координатах
Закон Гей-Люссака (изобарный процесс)
Изобарным процессом называют изменение состояния газа, при котором его давление остаётся постоянным.
Для неизменной массы газа при постоянном давлении отношение объема газа к температуре есть величина постоянная:
Этот закон также следует из уравнения Менделеева - Клапейрона:
![]()
изобарами .
Рассмотрим два изобарных процесса с давлениями и title="Rendered by QuickLaTeX.com" height="18" width="95" style="vertical-align: -4px;">. В координатах и изобары будут иметь вид прямых линий, перпендикулярных оси (рис.2 а,б).
Определим вид графика в координатах .Обозначив константу буквой , запишем функциональную зависимость объема от температуры при изобарном процессе:
Видно, что при постоянном давлении объем газа прямо пропорционален его температуре. Графиком прямой пропорциональности, а, следовательно, и графиком изобары в координатах является прямая, проходящая через начало координат (рис.2, в). В реальности при достаточно низких температурах все газы превращаются в жидкости, к которым газовые законы уже неприменимы. Поэтому вблизи начала координат изобары на рис.2, в) показаны пунктиром.

Рис.2. Графики изобарных процессов в различных координатах
Закон Шарля (изохорный процесс)
Изохорным процессом называют изменение состояния газа, при котором его объем остаётся постоянным.
Для неизменной массы газа при постоянном объеме отношение давления газа к его температуре есть величина постоянная:
Для двух состояний газа этот закон запишется в виде:
Этот закон также можно получить из уравнения Менделеева - Клапейрона:
![]()
Графики зависимости параметров газа при постоянном давлении называются изохорами .
Рассмотрим два изохорных процесса с объемами и title="Rendered by QuickLaTeX.com" height="18" width="98" style="vertical-align: -4px;">. В координатах и графиками изохор будут прямые, перпендикулярные оси (рис.3 а, б).
Для определения вида графика изохорного процесса в координатах обозначим константу в законе Шарля буквой , получим:
Таким образом, функциональная зависимость давления от температуры при постоянном объеме является прямой пропорциональностью, графиком такой зависимости является прямая, проходящая через начало координат (рис.3, в).

Рис.3. Графики изохорных процессов в различных координатах
Примеры решения задач
ПРИМЕР 1
| Задание | До какой температуры нужно изобарически охладить некоторую массу газа с начальной температурой , чтобы объем газа уменьшился при этом на одну четверть? |
| Решение | Изобарный процесс описывается законом Гей-Люссака:
По условию задачи объем газа вследствие изобарного охлаждения уменьшается на одну четверть, следовательно: откуда конечная температура газа: Переведем единицы в систему СИ: начальная температура газа . Вычислим:
|
| Ответ | Газ нужно охладить до температуры . |
ПРИМЕР 2
| Задание | В закрытом сосуде находится газ под давлением 200 кПа. Каким станет давление газа, если температуру повысить на 30%? |
| Решение | Так как сосуд с газом закрытый, объем газа не меняется. Изохорный процесс описывается законом Шарля:
По условию задачи температура газа повысилась на 30%, поэтому можно записать: Подставив последнее соотношение в закон Шарля, получим: Переведем единицы в систему СИ: начальное давление газа кПа= Па. Вычислим: |
| Ответ | Давление газа станет равным 260 кПа. |
ПРИМЕР 3
| Задание | В кислородной системе, которой оборудован самолет, имеется |
| Решение | Изотермический процесс описывается законом Бойля-Мариотта: |
Изобарный процесс
Графики изопроцессов в различных системах координат
Изобарный процесс (др.-греч. ισος, isos - «одинаковый» + βαρος, baros - «вес») - процесс изменения состояния термодинамической системы при постоянном давлении ()
Зависимость объёма газа от температуры при неизменном давлении была экспериментально исследована в 1802 году Жозефом Луи Гей-Люссаком. Закон Гей-Люссака : При постоянном давлении и неизменных значениях массы газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const.
Изохорный процесс
Изохорный процесс (от греч. хора - занимаемое место) - процесс изменения состояния термодинамической системы при постоянном объёме (). Для идеальных газов изохорический процесс описывается законом Шарля : для данной массы газа при постоянном объёме, давление прямо пропорционально температуре:
Линия, изображающая изохорный процесс на диаграмме, называется изохорой.
Ещё стоит указать что поданная к газу энергия расходуется на изменение внутренней энергии то есть Q = 3* ν*R*T/2=3*V*ΔP, где R - универсальная газовая постоянная, ν количество молей в газе, T температура в Кельвинах, V объём газа, ΔP приращение изменения давления. а линию, изображающая изохорный процесс на диаграмме, в осях Р(Т), стоит продлить и пунктиром соединить с началом координат, так как может возникнуть недопонимание.
Изотермический процесс
Изотермический процесс (от греч. «термос» - тёплый, горячий) - процесс изменения состояния термодинамической системы при постоянной температуре ()(). Изотермический процесс описывается законом Бойля - Мариотта :
При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.
Изоэнтропийный процесс
Изоэнтропийный процесс - процесс изменения состояния термодинамической системы при постоянной энтропии (). Изоэнтропийным является, например, обратимый адиабатический процесс: в таком процессе не происходит теплообмена с окружающей средой. Идеальный газ в таком процессе описывается следующим уравнением:
где - показатель адиабаты , определяемый типом газа.
Wikimedia Foundation . 2010 .
Смотреть что такое "Изопроцессы" в других словарях:
Изопроцессы термодинамические процессы, во время которых масса и ещё одна из физических величин параметров состояния: давление, объём или температура остаётся неизменной. Так, неизменному давлению соответствует изобарный процесс, объёму изохорный … Википедия
Молекулярно кинетическая теория (сокращённо МКТ) теория, рассматривающая строение вещества с точки зрения трёх основных приближенно верных положений: все тела состоят из частиц, размером которых можно пренебречь: атомов, молекул и ионов; частицы… … Википедия
- (сокращённо МКТ) теория, рассматривающая строение вещества с точки зрения трёх основных приближенно верных положений: все тела состоят из частиц, размером которых можно пренебречь: атомов, молекул и ионов; частицы находятся в непрерывном… … Википедия
Книги
- Статистическое прогнозирование деформационно-прочностных характеристик конструкционных материалов , Г. Плювинаж , В. Т. Сапунов , В настоящей книге представлен новый метод, предлагающий общую методологию прогнозирования характеристик кинетических процессов, единую для металлических и полимерных материалов. Метод… Категория: Учебники для ВУЗов Издатель: